A vida levou quatro bilhões de anos surgindo, desenvolvendo-se e lutando para resistir à catástrofe, vencendo os obstáculos do passado e imaginando os futuros possíveis, aventurando-se e sobrevivendo. Mas em toda a história do planeta nunca tinha acontecido isto: que uma criatura da evolução tomasse as rédeas de seu próprio destino biológico. Parece incrível, mas os cientistas acreditam que atingimos este ponto, e que por isso não temos outro remédio que nos pormos a pensar – com toda a profundidade ao nosso humilde alcance —no abismo conceitual que se descortina diante de nós. Podemos nos considerar sortudos, pelo menos enquanto testemunhas da história em escala cósmica.
A grande novidade não poderia ter nome mais frustrante: crisp, o nome em inglês das batatinhas fritas em saquinhos. Na verdade é uma sigla – explicada adiante — que designa uma nova técnica para modificar os genomas, uma técnica tão simples, barata e eficiente que pela primeira vez põe ao nosso alcance a possibilidade de reescrever o código genético humano: nas células doentes do corpo, sim, mas também nos óvulos e espermatozoides que determinam o futuro de nossos filhos, dos filhos de nossos filhos e de toda a linhagem que emergirá deles. Um passaporte para o futuro.
Os cientistas mais diretamente envolvidos neste avanço se reuniram em 24 de janeiro no Fórum IGI de Bioética, em Napa, Califórnia, organizado pela Innovative Genomics Initiative (IGI) da Universidade de Califórnia (em suas sedes de Berkeley e San Francisco). Seu objetivo não era tanto confirmar as imensas possibilidades da nova tecnologia de modificação de genoma – todos eles as conheciam claramente — quanto examinar com espírito autocrítico seus riscos e desenrolares imprevistos, numa tentativa de poder contorná-los enquanto é tempo. O prêmio Nobel David Baltimore e outras duas dezenas de pesquisadores apresentam na revista Science as conclusões da reunião.
“A promessa da chamada ‘medicina de precisão’ vem impulsionada pela sinergia entre duas poderosas tecnologias”, explicam Baltimore e seus colegas. A primeira é bem conhecida: o exponencial desenvolvimento e barateamento do sequenciamento (leitura) de DNA, que já trouxe a maior parte da informação fundamental sobre as alterações genéticas que estimulam o desenvolvimento das doenças. A segunda é o crisp.
Crisp é a sigla de clustered regularly interspaced short palindromic repeats, cuja tradução não ajuda muito: sequências curtas palíndromas agrupadas e regularmente espaçadas. Trata-se de uma sequência de DNA bacteriano muito particular, com trechos curtos que se repetem a intervalos regulares e que podem ser lidos da mesma maneira, mesmo que o sentido de leitura seja invertido (ou seja, como palíndromos, tais como arara, osso ou rotor, mas na linguagem do DNA).
Essas sequências se comportam na natureza como verdadeiros engenheiros genéticos: são capazes de incorporar genes exóticos, como os de um vírus, e de comandá-los, em coisas como ativá-los, reprimi-los ou introduzi-los em outro lugar do genoma. As bactérias usam crisp como um sistema de defesa contra vírus: integram seus genes e os utilizam contra o próprio agente invasor. Mas os geneticistas aprenderam a usar crisp como um veículo para substituir, corrigir ou modificar o genoma de qualquer animal.
O método foi testado com sucesso em ratos e macacos, e por isso os cientistas acreditam que é a hora de estudar se tem utilidade médica para os humanos. Especificamente, para curar doenças genéticas em sua linha germinativa, quer dizer, não no próprio doente, e sim em seus filhos e no restante de sua descendência futura. Por enquanto, isso é ilegal em todos os países que regulamentaram a embriologia humana, que são todos os que têm a capacidade técnica necessária. Baltimore e seus colegas creem que seja a hora de discutir os aspectos éticos e legais para promover as reformas legais pertinentes. Ou para não fazer isso, caso se determine que os riscos não compensam os benefícios.
O prêmio Nobel e os outros especialistas são explícitos em suas recomendações: assegurar que os experimentos não sejam tentados em países com regras demasiadamente frouxas; discutir em fóruns científicos, bioéticos e governamentais as implicações sociais, éticas e ambientais; promover a transparência do debate e a informação pública “sobre esta nova era da biologia humana”; formar um grupo internacional representativo de especialistas em genética, indústria, direito e bioética.
“A confiança pública na ciência”, dizem Baltimore e seus colegas, “requer transparência em tempo real e discussão aberta”. Seguir esse conselho também seria uma novidade importante.
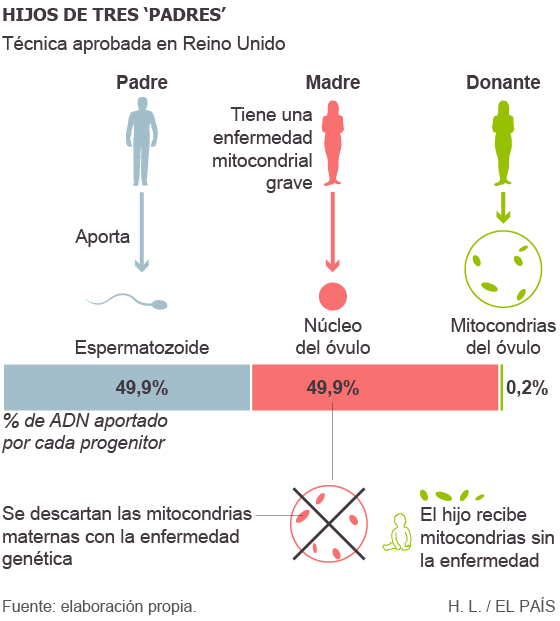
A grande maioria das doenças hereditárias ocorre por mutações no genoma nuclear – aquele situado no núcleo de cada célula –, e os projetos para corrigi-las, mesmo que já sejam tecnicamente possíveis, ainda precisam superar um difícil processo para demonstrar sua segurança e garantir sua legalidade. Os primeiros progressos na modificação genética da linha germinativa afetarão provavelmente um irmão menor do genoma nuclear, o pequeno DNA situado nas mitocôndrias, as usinas de energia das células, transmitido apenas por via materna.
“Um argumento a favor de modificar o genoma mitocondrial é que para essas doenças não existe uma boa alternativa”, explica Juan Carlos Izpisúa, do Instituto Salk, da Califórnia, um dos principais pesquisadores que estão desenvolvendo essa técnica. Para as doenças do genoma nuclear existe atualmente a possibilidade do diagnóstico pré-implantação: gerar uma dúzia de embriões por fecundação in vitro, analisar seu DNA e implantar apenas os que estiverem sem a mutação. Só que, enquanto o genoma nuclear é único, em cada célula há centenas ou milhares de mitocôndrias, algumas mutantes e outras não, o que torna inviável esse tipo de diagnóstico.
Existe outra opção, aprovada há muito pouco tempo no Reino Unido, conhecida popularmente como os “filhos de três pais”. Consiste em substituir as mitocôndrias doentes de um óvulo pelas de uma doadora sã e depois fecundar o óvulo com um espermatozoide (total: três progenitores). Mas nesse caso, metade do genoma mitocondrial e a metade materna do nuclear vêm de pessoas diferentes, e há evidências em ratos de que podem ser incompatíveis e levar a efeitos indesejados no feto.
O crisp e outras técnicas relacionadas são capazes de corrigir as mutações mitocondriais no óvulo (ou no óvulo fecundado), o que evitaria todos os problemas anteriores. Apesar do precedente (relativo) do Reino Unido, comprovar a validade dessa técnica em humanos exige algumas mudanças na lei na maioria dos países. Izpisúa sondou o Ministério da Saúde espanhol, sem sucesso. As experiências foram feitas nos Estados Unidos, onde é possível criar embriões para pesquisa, desde que não sejam empregados recursos públicos.
EL PAÍS.com
Nenhum comentário:
Postar um comentário