
Você provavelmente já ouviu dizer que toda matéria é feita de conjuntos de átomos. Você também provavelmente já sabe que é impossível vê-los a olho nu. Somos ensinados a acreditar na ideia de que os átomos estão ali, interagindo entre si e formandos os blocos que constroem nosso mundo.
Para muita gente, porém, isso não é suficiente. A ciência se orgulha da maneira como usa observações reais para desvendar os mistérios do universo. Então, como chegamos à conclusão de que os átomos existem e aprendemos os segredos de suas estruturas?
Não adianta tentar o microscópio: o que torna um objeto visível é a maneira como reflete as ondas de luz, mas os átomos são tão menores do que o comprimento de onda de luz visível que os dois não interagem. Ou seja, os átomos são invisíveis até para a luz.
Mas os átomos têm efeitos observáveis em algumas das coisas que podemos ver.
Em 1785, o cientista holandês Jan Ingenhousz estava estudando um fenômeno estranho que ele não conseguia explicar. Partículas minúsculas de carvão se movimentavam com rapidez na superfície de um recipiente com álcool em seu laboratório.
Cerca de 50 anos depois, em 1827, o botânico escocês Robert Brown descreveu algo curiosamente parecido. Ele observava grãos de pólen com seu microscópio e notou que alguns deles soltavam pequenas partículas – que se afastavam dos grãos de uma forma agitada e aleatória.
Em princípio, Brown se perguntou se as partículas eram alguma espécie de organismo desconhecido. Ele repetiu a experiência com outras substâncias como poeira de rocha, que nunca esteve viva, e observou o mesmo movimento estranho de novo.

Sistema planetário minúsculo
Ainda levaria quase um século para a ciência chegar a uma explicação. Albert Einstein desenvolveu uma fórmula matemática que previa esse tipo de movimento particular – então chamado de movimento Browniano, em homenagem a Robert Brown.
A teoria de Einstein era de que as partículas dos grãos de pólen se movimentavam porque estavam constantemente se chocando com milhões de moléculas minúsculas de água.
Em 1908, observações reforçadas com cálculos haviam confirmado a teoria, e em uma década os físicos conseguiram ir além. Ao separar cada átomo individual, eles começaram a entender mais sobre suas estruturas internas.
O nome vem do grego atomos, que significa indivisível. Mas os físicos já sabem hoje que os átomos não são sólidos como pequenas esferas, e sim uma espécie de sistema planetário elétrico minúsculo.
Eles são constituídos por três partes principais: prótons, nêutrons e elétrons. Pense nos prótons e nos nêutrons unidos no centro formando o “sol”, ou núcleo. E os elétrons orbitando esse núcleo, como planetas.
Se os átomos já são extremamente pequenos, essas partículas subatômicas são ainda menores. Curiosamente, a primeira partícula a ser descoberta foi a menor de todas – o elétron.
Para se ter uma ideia da diferença de tamanho, os prótons no núcleo são cerca de 1.830 vezes maiores que os elétrons. A proporção seria a mesma que pequenas bolas de gude orbitando um balão de ar quente.
Luminosidade
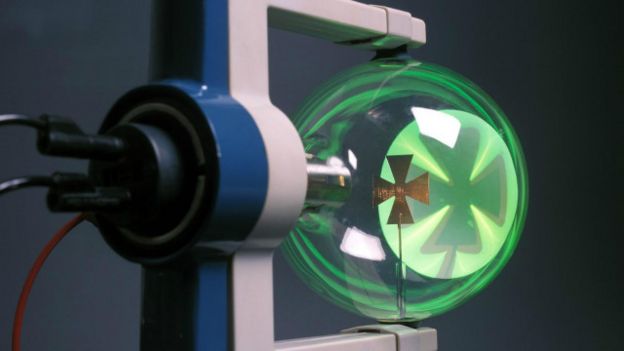
Mas como sabemos que essas partículas estão lá? A resposta é que, apesar de minúsculas, elas têm um grande impacto. O físico britânico que descobriu os elétrons, J. J. Thomson, usou um método particularmente engenhoso para provar sua existência em 1897.
Ele usou um dispositivo especial chamado tubo de Crookes – um pedaço de vidro com um formato estranho do qual quase todo o ar é retirado por uma máquina. Uma carga elétrica negativa era aplicada então em um dos lados do tubo. Essa carga era suficiente para retirar das moléculas de gás restantes no tubo alguns de seus elétrons.
Os elétrons têm carga negativa, então a carga negativa aplicada ao tubo os repelia ao outro lado. E, graças ao vácuo parcial, esses elétrons podiam sair em disparada pelo tubo sem nenhum grande átomo para atrapalhá-los pelo caminho.
A carga elétrica fazia com que os elétrons se movessem com extrema rapidez – cerca de 59.500 quilômetros por segundo – até se chocarem com o vidro no outro extremo, batendo também em outros elétrons associados aos átomos.
Surpreendentemente, as colisões entre essas minúsculas partículas geraram tanta energia que criaram uma luminosidade amarelo-esverdeada.
Se você se pergunta como esses elétrons podiam sair voando independentemente de seus átomos, isso se deve a um processo chamado ionização, no qual – neste caso – uma carga elétrica modifica a estrutura do átomo ao empurrar esses elétrons para o espaço em sua volta.
De fato, é por conta dessa facilidade em manipular os elétrons que os circuitos elétricos são possíveis. Elétrons se movimentam de um átomo a outro de um fio de cobre, carregando consigo a carga pela extensão do fio.
Os átomos, nunca é demais lembrar, não são pedaços sólidos de matéria, mas sistemas que podem ser modificados ou passar por mudanças estruturais.

Núcleo demonstrado
Mas a descoberta dos elétrons sugeria que havia algo a mais para aprender sobre os átomos. O trabalho de Thomson revelou que os elétrons tinham carga negativa – mas ele sabia que os próprios átomos não tinham nenhuma carga. A conclusão foi de que eles deveriam conter partículas misteriosas com carga positiva para balancear a carga negativa dos elétrons.
Experiências no começo do século 20 identificaram essas partículas positivas e ao mesmo tempo revelaram a estrutura interna do átomo semelhante à de um sistema solar.
Ernest Rutherford e seus colegas pegaram folhas de papel alumínio bem finas e as colocaram sob um feixe de radiação com carga positiva. A maior parte da radiação passou para o outro lado, como Rutherford imaginava, já que a folha era bem fina. Mas surpreendentemente, parte dela bateu e voltou.
Rutherford então sugeriu que os átomos na folha de papel alumínio deveriam conter áreas pequenas e densas com cargas positivas, já que nada mais teria o potencial de refletir a radiação em um grau tão forte.
Ele havia encontrado as cargas positivas do átomo – e simultaneamente provou que ela estava concentrada em uma massa compacta de uma forma que os elétrons não estão. Em outras palavras, ele demonstrou a existência de um núcleo denso dentro do átomo.

Cálculo
Agora, a massa dos átomos podia ser estimada. Mas ainda havia um problema: os cálculos não batiam.
“Um átomo de carbono tem seis elétrons, e portanto seis prótons em seu núcleo – seis cargas positivas e seis negativas. Mas o núcleo de carbono não pesa seis prótons, ele pesa o equivalente a 12 prótons”, observa Harry Cliff, pesquisador da Universidade de Cambridge e curador do Museu da Ciência de Londres.
Logo se chegou à conclusão de que as outras seis partículas nucleares deveriam ter a mesma massa que os prótons, mas ter carga neutra: os nêutrons. Mas ninguém conseguia provar isso. Pelo menos até os anos 1930.
O físico James Chadwick já vinha trabalhando em sua teoria havia anos quando fez sua descoberta, em 1932.
Ele lançou raios gama, que têm carga neutra e alto grau de penetração, em uma substância que ele sabia ser rica em prótons. Surpreendentemente, os prótons foram empurrados para longe do material como se tivessem sido atingidos por partículas com a mesma massa – como bolas de bilhar atingidas por outras bolas de bilhar.
Os raios gama não são capazes de desviar os prótons dessa maneira, então Chadwick descobriu que as partículas em questão deveriam ter a mesma massa que os prótons, mas sem sua carga elétrica: eram os nêutrons.

Ver para crer
Com a estrutura do átomo descoberta, o que faltava era uma imagem – muita gente só acredita no que pode ver.
Nos anos 1930 isso era impossível, mas o trabalho de cientistas como Thomson, Rutherford e Chadwick ajudou a criar mecanismos para produzir essas imagens, com microscópios eletrônicos, que usam feixes de elétron em lugar de raios de luz.
Um feixe de luz tem comprimento de onda milhares de vezes maior do que um feixe de elétrons, que assim é capaz de ser desviado por átomos minúsculos para gerar uma imagem que a luz é incapaz de captar.
Mas os átomos não estão simplesmente presentes nas coisas de maneira estável, esperando para serem examinados. Muitas vezes, eles estão em decomposição, o que significa que são radioativos.
Há vários elementos naturalmente radioativos. O processo gera energia, que forma a base da energia nuclear – e das bombas nucleares. O trabalho dos físicos nucleares envolve geralmente tentar entender as reações nas quais o núcleo do átomo passa por mudanças fundamentais como essa.
Após mais de dois séculos de pesquisas, os cientistas não somente descobriram como os átomos são, mas também suas estruturas complexas e as suas mudanças – muitas das quais ocorrem naturalmente.
E, ao estudarmos os átomos dessa forma, fomos capazes de desenvolver novas tecnologias, aproveitar a energia de reações nucleares e entender melhor o mundo que nos cerca.
Também aprendemos a nos proteger melhor da radiação e descobrir como os materiais mudam sob condições extremas.
“Considerando o quão pequeno um átomo é, é impressionante ver o quanto a física consegue tirar deles”, observa a física nuclear Laura Harkness-Brennan, da Universidade de Liverpool.
Nenhum comentário:
Postar um comentário